
Lorsque l’on comprime un gaz, il se liquéfie; lorsqu’on le détend il retourne à l’état gazeux.
Ce changement d’état s’accompagne d’effets énergétiques : le passage de l’état gazeux à l’état liquide libère de la chaleur; le passage de l’état liquide à l’état gazeux (évaporation) absorbe de la chaleur.
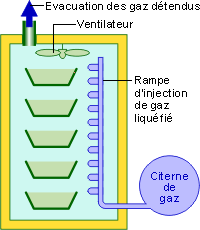
Pour produire du froid cryogénique, on utilise un fluide à basse température d’ébullition.
Ce fluide est préalablement liquéfié industriellement puis stocké sous pression. Ce fluide est vaporisé via des buses dans l’enceinte à refroidir. En entrant dans celle-ci, il se détend, passe de l’état liquide à l’état gazeux en absorbant une grande quantité de chaleur.
Les fluides utilisés sont soit l’azote, soit le dioxyde de carbone.
L’azote (N2)
- température d’ébullition (à pression atmosphérique) : – 195,8 °C
- pression de stockage : 2 bars
- pouvoir réfrigérant : 69 kcal./litre N2
Le gaz carbonique (CO2)
- température de sublimation* : – 78,9 °C
- pression de stockage : 20 bars
- pouvoir réfrigérant :76 kcal./kg CO2
* : le gaz carbonique a la propriété de passer directement de l’état solide à l’état gazeux (sublimation).
L’azote liquide se vaporise directement, tandis que le gaz carbonique se transforme en neige puis se vaporise.



Auteur : les anciens
Notes :
11/03/09, par Julien
style css des tableaux : Thibaud
Mai 2009, Sylvie :