Sommaire

L’oxygène renforce la corrosion de l’acier
Au départ, la corrosion électronique du fer par l’hydrogène
Le fer, en présence d’un électrolyte, va se dissoudre sous la forme d’un ion positif Fe++ et libérer 2 électrons. Il envoie donc dans la solution un cation (atome de métal chargé d’électricité positive) et en même temps, il se charge lui-même d’électricité négative. On dit qu’un potentiel électrique se crée entre le métal et la solution de ses ions.
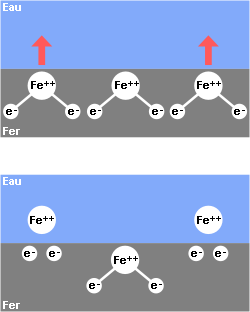
Si l’eau est de très haute pureté, il n’existera aucun corps susceptible de capter les électrons issus de la dissolution du fer. Le phénomène se poursuivra jusqu’à une valeur d’équilibre où le nombre de charges électriques en présence (positives dans l’eau, négatives à la surface du métal) créera un champ magnétique suffisant pour bloquer la migration du fer.
Mais si le fer est en contact avec l’eau du robinet, ou a fortiori avec l’eau de mer ou un électrolyte quelconque, le circuit électrique va pouvoir se refermer. En effet, l’eau sera partiellement ionisée :
H2O –> H+ + (OH)-
Et une certaine quantité d’ions H+ vont réagir sur une partie du métal en récupérant les électrons libérés par la dissolution du fer et former de l’hydrogène gazeux (apparition de petites bulles d’hydrogène) :
2 H+ + 2 électrons –> H2
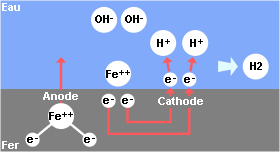
La corrosion se traduit par une circulation d’électrons. Le métal qui cède des électrons constitue l’anode, les ions H+ qui absorbent les électrons constituent la cathode. Cette fois, le Fe continue à se dissoudre en Fe++ !
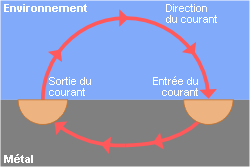
Remarque : par convention, le courant (+) est représenté dans le sens contraire de la circulation des électrons (-).
La quantité de courant qui traverse cette pile est proportionnelle à la quantité de métal qui se dissout à l’anode. Un ampère par an dissoudra environ 9 kg d’acier par an. Seule, la présence de bulles d’hydrogène sur la cathode formera une couverture isolante capable de réduire le débit de courant et de freiner la corrosion.
Un responsable de la maintenance peut contrôler si de la corrosion se produit dans son réseau : en approchant une flamme du dégazeur, s’il y a présence d’hydrogène une petite explosion se fera lors de l’ouverture de la soupape.
Le renforcement de la corrosion en présence d’oxygène
La plupart des eaux contiennent de l’oxygène dissous. Cette teneur en oxygène diminue si la température augmente, mais augmente si la pression s’accroît.
1° Cet oxygène se combine avec l’hydrogène H2 pour former de l’eau :
2 H+ + 1/2 O2 + 2 électrons –> H2O
On évite ainsi l’accumulation d’hydrogène et la corrosion continue alors sans empêchements.
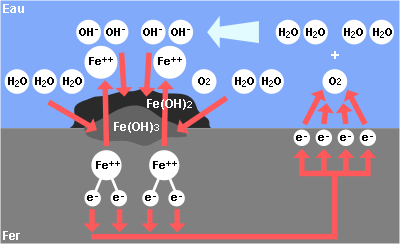
2° L’oxygène capte lui-même les électrons et forme des ions OH- :
O2 + 2 H2O + 4 électrons –> 4 (OH)-
Ceux-ci vont se combiner avec les Fe++ pour former des hydroxydes ferreux et ferriques.
Fe++ + 2 (OH)- –> Fe(OH)2
Fe(OH)2 + 1/2 O2 + 2 H2O –> Fe(OH)3
Ce qu’on appelle couramment de la rouille !
Conséquence
Pour éviter ces corrosions, l’eau des circuits de chauffage est désaérée (dégazée par des purgeurs automatiques) : les quantités d’oxygène seront réduites.
De plus, dans un circuit de chauffage, c’est toujours la même eau qui circule, on parle “d’eau morte”. Si de l’eau nouvelle est ajoutée au circuit, il faut rechercher l’origine de la fuite pour éviter de recharger l’eau en agent corrosif.
La présence de boues renforce la corrosion de l’acier
La formation d’une pile au sein d’un métal
Comme vu ci-dessus, une pile est donc formée au sein d’un même métal : entre deux points voisins de la tuyauterie se constitue un couple électrique. Comment se fait-il qu’une zone devienne anodique et une autre cathodique ?
Une différence locale dans la qualité de l’acier peut déjà le justifier : présence d’impuretés (oxydes), d’éraflures ou d’entailles, … Ce n’est pas un hasard si de la corrosion apparaît souvent à l’endroit du filetage des tuyauteries assemblées.
Mais ce qui sera souvent l’élément facilitateur de la corrosion, c’est l’existence d’une aération différentielle en oxygène : les zones faiblement aérées constituent des anodes, alors que les zones fortement aérées deviennent des cathodes.
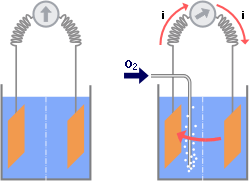
| C’est Evans qui a mis en évidence cette propriété par l’expérience ci-dessous :
Lorsqu’un matériau métallique plonge dans un milieu dont les teneurs en oxygène sont différentes (par injection d’oxygène localement), il apparaît un courant électrique. La plaque la moins aérée se dissout dans le milieu et libère des électrons. Par exemple pour le Fer : Fe –> Fe++ + 2 électrons |
Une corrosion sous les boues du réseau
Cette corrosion par aération différentielle se rencontre dans les installations de chauffage : les zones sous une couche de boues au fond d’un radiateur ou d’une chaudière (faiblement aérées) se corrodent car elles constituent des anodes, alors que les zones soumises à un débit plus élevé (fortement aérées) deviennent des cathodes.
Ces boues sont formées de résidus de montage (limailles, produits de soudure,…) ou encore des sédiments présents dans l’eau (sable, argile,…). L’usage d’un filtre à l’entrée du réseau sera toujours utile, filtre avec un pouvoir de rétention de 25 à 50 microns.
Deux métaux différents se corrodent entre-eux
La noblesse des métaux
Comme le fer, tous les métaux plongés dans une solution établissent un potentiel électrique entre eux et la solution : c’est le potentiel d’électrode simple. Ces potentiels sont repris dans le tableau ci-dessous, avec le potentiel de l’hydrogène pris comme zéro de référence (pour une raison non développée ici).
|
Élément |
Potentiel (Volts) |
| Sodium | – 2.7 |
| Magnésium | – 2.3 |
| Aluminium | – 1.7 |
| Zinc | – 0.8 |
| Chrome | – 0.7 |
| Fer | – 0.4 |
| Nickel | – 0.3 |
| Etain | – 0.1 |
| Plomb | – 0.1 |
| Hydrogène | 0 |
| Cuivre | + 0.3 |
| Argent | + 0.8 |
| Platine | + 1.2 |
| Or | + 1.4 |
Il est intéressant d’analyser de plus près cette liste : elle nous fournit les tendances relatives à la corrosion pour ces éléments. Par exemple, le sodium réagit violemment avec l’eau tandis que le platine n’est pas attaqué par l’eau. Pour cette raison, l’or et l’argent sont souvent trouvés à l’état natif, tandis que le fer et l’aluminium sont toujours trouvés sous formes combinées (oxydes) dans les mines.
On parle couramment de hiérarchie, de noblesse des métaux, l’or étant le plus noble.
La création d’une pile entre 2 métaux
Lorsque deux métaux sont mis en contact, une différence de potentiel électrique apparaît entre eux, un couple galvanique est créé. Une corrosion dite galvanique va s’enclencher et ce, d’autant plus fortement que la différence de potentiel entre les métaux sera forte.
Par exemple, le cuivre et l’aluminium forment une pile puissante : 2,0 V (= 1,7 + 0,3).
Attention à l’association entre radiateurs en aluminium et tuyauteries en cuivre !
Par contre, le magnésium et l’aluminium formeront une pile plus faible : 0,6 V (2,3 – 1,7).
Un métal situé plus haut dans la série agira comme anode et celui plus bas se comportera comme cathode lorsque les deux métaux sont en contact. Ainsi, entre le fer et le cuivre, c’est l’acier, moins noble, qui constituera l’anode et cédera ses électrons, alors que le cuivre, plus noble, constituera la cathode.
Les phénomènes de couple galvanique seront renforcés ou diminués par d’autres paramètres. Par exemple, le cuivre s’érode facilement et de nombreuses particules de cuivre se mettent en circulation, se déposent sur les tuyauteries acier et constituent de nombreuses micropiles enclenchant le processus de corrosion. C’est une des raisons qui font que l’utilisation du cuivre est proscrite en amont de tuyauteries galvanisées.
Un ballon d’eau chaude sanitaire en acier galvanisé se détériore s’il est raccordé à l’arrivée d’eau de ville par des tuyauteries en cuivre. Si le cuivre est situé en aval de l’acier, il y aura peu de problèmes.
À noter que si l’aluminium est un métal réactif (il se situe très haut dans la série des potentiels …), il possède une bonne résistance à la corrosion. Ce métal forme rapidement en surface une couche d’alumine (Al2O3) qui arrête la corrosion en beaucoup de milieux environnants.
La protection contre la corrosion électrochimique
Voici quelques exemples de procédés utilisés pour combattre la corrosion :
- Choix de combinaisons de métaux aussi voisins que possible dans la série galvanique.
- Revêtements protecteurs tels que la peinture. Un tel revêtement constitue une barrière entre le métal et son environnement, empêchant le courant de circuler.
- Addition d’inhibiteurs chimiques dans la solution en contact avec le ou les métaux. Ils créent généralement une fine pellicule d’hydroxydes ou de sels à la surface du métal. Le passage du courant est freiné et la corrosion aussi.
- Isolation des métaux différents par une rondelle de Bakélite, de plastique, … à l’endroit de leur contact.

Isolement électrique intégré dans un raccord boulonné entre deux métaux différents.
- Protection cathodique : un courant électrique extérieur est appliqué au métal de telle sorte que le courant entre dans le métal par la totalité de sa surface. Les régions anodiques sont transformées en régions cathodiques. Ce courant s’oppose au courant anodique de corrosion.
- Protection par “anode sacrificielle” : un métal ne peut s’oxyder si l’on fait en sorte qu’il soit la cathode d’une pile. Ainsi, dans l’eau de mer, un objet en cuivre est protégé s’il est relié électriquement à une électrode de fer. C’est le fer qui sera oxydé puisqu’il constitue l’anode de la pile associant les couples Cu++/Cu et Fe++/Fe). De même, un objet en fer (une coque de bateau, par exemple) est protégé par des anodes en zinc fixées sur lui : c’est le zinc qui sera attaqué (= “anode consommable”). De même encore, on peut protéger des canalisations en fonte enfoncées dans le sol en les reliant de loin en loin, à des électrodes d’un métal plus réducteur que le fer (Zn, Mg), également enterrées.Dans les boilers (réservoirs d’eau chaude sanitaire), c’est souvent une électrode soluble de magnésium qui sera placée pour protéger la cuve en acier. Elles doivent être renouvelées après quelques années.
- Ne pas adoucir trop fortement l’eau : un léger dépôt renforce la protection interne de la tuyauterie. On évitera donc de régler l’adoucisseur en dessous des 15°F.





Auteur : les anciens
Eté 2008 : Brieuc.
Notes : 06.02.09