Sommaire
Niveau de propreté particulaire et bactérienne de l’air
En fonction de la zone, le traitement d’air doit répondre en tout ou en partie aux objectifs suivants :
- limiter la concentration dans l’air des particules, des virus et des bactéries,
- éliminer les gaz dangereux (gaz anesthésique, …) et explosifs,
- éviter les contaminations entre différentes zones (contaminations croisées).
Le maintien de la qualité de l’air ne se résume donc pas à l’apport d’air neuf hygiénique. Il faut en outre supprimer tout risque d’aérobiocontamination soit au départ de certains locaux du bâtiment (zones septiques), soit venant de l’extérieur.
La pression relative entre les locaux, la filtration, le recyclage de l’air et la désinfection des équipements jouent donc un rôle tout aussi important que l’apport d’air neuf.
L’importance de chacune de ces “missions” varie en fonction du risque de contamination que l’on rencontre dans les différentes zones du bâtiment. On parle de zones à risque classées de 2 à 4 en fonction du risque de aérobiocontamination encouru, tant pour les patients que pour la communauté hospitalière (norme EN ISO 14644 et EN ISO 14698). La norme NF S90-351 s’inspire de ces deux normes européennes pour donner des recommandations en termes de conception, d’exploitation, de maintenance et d’utilisation des installations de traitement d’air pour les établissements de santé.
| Afin d’évaluer le risque de contamination de la zone considérée en fonction de l’activité, les taux de renouvellement d’air et les pressions différentielles qui en découlent. |
Confort des occupants
Le niveau du confort d’une zone à risque contrôlé passe aussi par l’évaluation du confort des malades, du personnel soignant et des visiteurs. Les consignes de température, du taux d’humidité, de la vitesse de déplacement d’air, fonction du type d’intervention réalisée, sont à respecter et à contrôler en période d’occupation de la zone, surtout en présence d’apports calorifiques importants.
Tout spécialement, un taux minimum d’humidité relative doit être maintenu pour éviter les risques d’explosion des gaz anesthésiants.
| Afin d’évaluer le niveau de confort à atteindre dans les locaux. |
“Tout air neuf” ou “recyclage” ?
Comme dans toute autre zone, il est nécessaire d’assurer le confort respiratoire des occupants. De plus, les filtres de la chaine de traitement de l’air ne peuvent pas arrêter les polluants chimiques tels que les gaz anesthésiants. C’est pour cette raison, en plus de l’élimination des polluants dus à la présence humaine, qu’il est nécessaire d’effectuer un apport d’air neuf. Les taux de brassage importants servent en grande partie à atteindre le niveau de propreté souhaité au niveau particulaire et bactérien.
La conception moderne des “zones à risque” a fortement évolué malgré l’imprécision qui règne au niveau des réglementations. C’est aux salles blanches industrielles que l’on doit cette avancée majeure. Ce n’est que suite au développement catastrophique des infections nosocomiales qu’on s’est intéressé de près aux systèmes de ventilation et climatisation dans les hôpitaux et à leur normalisation.
La phobie du recyclage est encore bien présente dans les mentalités mais tend à laisser la place à une intégration certaine de ce principe dans les nouveaux projets de conception; ce qui est favorable du point de vue de l’énergie, de l’environnement et du portefeuille du maître d’ouvrage.
Dans la conception des zones à risque ci-dessous, nous avons pris l’option de ne considérer que le système à recyclage.
À noter également que le système d’humidification n’est pas repris dans les schémas. Un humidificateur à vapeur en sortie de caisson est recommandé pour les qualités hygiéniques de ce système.
Zones à risque contrôlé
1. Introduction
2. Zones à risque modéré de biocontamination
(zones à risque 2)
| Zones à risque 2
Zones pour patients à risque infectieux modéré : médecine interne ou spécialisée, rééducation fonctionnelle, maternité, pédiatrie, long et moyen séjour, psychiatrie, consultations externes, hôpitaux de jour à orientation infectieuse. |
Objectif d’épuration : classe ISO 8 (moins de 3 500 000 particules > 0,5 μ m par m³ d’air).
L’air est pulsé mécaniquement dans chaque local au moyen de diffuseurs classiques et en partie repris par un recycleur propre au local ou au groupe de locaux concernés. Le dernier étage de filtration est d’efficacité minimum EU10 (95 % DOP ou H11) avec un préfiltre EU7 (85 % OPA ou F7). Une surpression des salles est assurée par un débit d’air neuf introduit plus élevé que celui extrait.

Ventilation des zones à risques 2 :
1/3 de l’air est extrait en partie haute pour éliminer les gaz anesthésiques plus légers que l’air.
3. Zones à haut risque de biocontamination
(zone à risques 3)
| Zones à risques 3
Zones pour patients à haut risque infectieux : réanimation, soins intensifs, explorations fonctionnelles vasculaires, néonatalogie, hémodialyse, hématologie, chimiothérapie, chirurgie, blocs opératoires conventionnels (chirurgie digestive propre ou contaminée, chirurgie gynécologique, obstétricale, urologique, ORL). |
Objectif d’épuration : classe ISO 7 (moins de 350 000 particules > 0,5 μ m par m³ d’air).
Il est reconnu que la principale source de contamination bactérienne est l’équipe chirurgicale elle-même. C’est donc dans les environs du champ opératoire que l’on retrouve la plus grande concentration de micro-organismes.
Utiliser une ventilation en flux turbulent, c’est-à-dire avec des diffuseurs traditionnels semblables à ceux utilisés dans les zones à risques 2 a pour conséquence de diluer rapidement la charge contaminante au travers de la pièce entière et rend donc le contrôle des risques plus difficile. La solution préconisée pour les zones à risques 2, solution par ailleurs bon marché, est donc à prendre avec précaution dans ce cas.
On lui préférera la solution du plafond soufflant à basse vitesse : l’air neuf est pulsé par un plafond soufflant à déplacement d’air à basse vitesse et couvrant la zone de plus haut risque. Il est repris en partie vers un recycleur spécifique au local ou à un groupe de salles semblables. Ce mode de pulsion entraîne un écoulement dirigé d’une vitesse inférieure à 0,25 m/s. Le mouvement transversal turbulent est très faible, de même que le mélange avec l’air ambiant. L’entraînement par déplacement d’air crée alors une véritable barrière dynamique autour de la zone de “plus haut risque”.
Le dernier étage de filtration est d’efficacité minimum EU13 (99,99 % OP ou H14). Ce filtre est placé le plus près possible du plafond diffusant (éventuellement à l’intérieur de ce dernier) avec un préfiltre EU8 (95 % OPA ou F8).
La plupart des normes internationales recommandent d’assurer une surpression dans les salles d’opération. Celle-ci est obtenue par un débit d’air neuf introduit supérieur à celui extrait. La norme allemande DIN 1946 prévoit, elle, la possibilité d’inverser cette pression relative dans le cas d’opérations septiques. Dans ce cas, l’air extrait doit aussi être filtré par un filtre absolu.
Le maintien des débits et des pressions dans le temps est important dans ce type de local, et ce malgré l’encrassement des filtres. Ceci peut se faire en équipant le ventilateur dune variation de vitesse du ventilateur.
Un taux d’air neuf de 5 vol/h est souvent considéré comme suffisant pour la dilution des gaz anesthésiques.
Parmi les différents types de plafond soufflant existants, les critères de choix sont
- la protection du patient,
- le confort des occupants (vitesse d’air dans la zone occupée et niveau sonore),
- l’absence de turbulence,
- la facilité de maintenance,
- le coût.
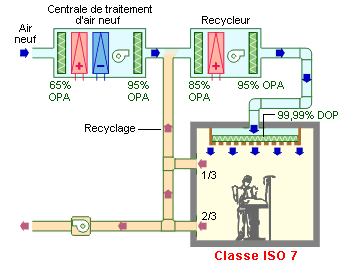
Ventilation des zones à risques 3 :
1/3 de l’air est extrait en partie haute pour éliminer les gaz anesthésiques plus légers que l’air.

Plafond soufflant en inox à une vitesse de 0,2 m/s, équipé d’un filtre H13 ou H14 et d’une dalle aveugle étanche pour le passage du scyalitique


Lorsque la conception architecturale de la salle d’opération ne permet pas le placement d’un plafond soufflant, on peut disposer les bouches de pulsion à jet dirigé de très faible vitesse sur le mur perpendiculaire à la table d’opération, dans le coin supérieur de la salle.
4. Zones à très haut risque de biocontamination
(zone à risques 4)
| Zones à risques 4
Zones pour patients à très haut risque infectieux : cancérologie, onco-hématologie, greffés, prématurés, brûlés, blocs opératoires aseptiques (orthopédie, cardio-vasculaire, neurochirurgie, ophtalmologie). |
Objectif d’épuration : classe ISO 5 (moins de 3 500 particules > 0,5 μ m par m³ d’air).
Le flux laminaire ou flux unidirectionnel est le système actuellement le plus efficace pour fournir de l’air stérile autour d’un malade à protéger ou de la plaie chirurgicale. Il assure en parallèle une liberté de mouvement suffisante au corps médical.
Pour garantir une efficacité optimale, il faut
- le moins de turbulence possible,
- une vitesse d’air comprise entre 0,3 et 0,6 m/s pour garantir la stabilité du flux,
- un espace réduit entre le soufflage et la zone à protéger,
- tenir compte des perturbations possibles (luminaires, …) et des mouvements de l’équipe chirurgicale.
Le degré de filtration recommandé est semblable à celui des zones à risques 3. Ici aussi, une surpression des salles est assurée par un débit d’air neuf introduit et non extrait.
Étant donné les importants taux de renouvellement d’air recommandés (200 à 600 vol/h), il est évidemment recommandé de circonscrire le plus exactement possible la zone à protéger, le reste de la salle ne subissant pas de traitement particulier.
On peut ainsi concevoir des flux verticaux ou horizontaux, totaux ou partiels. Dans tous les cas, une partie de l’air devra être extraite pour éliminer les gaz dangereux (gaz anesthésiques).
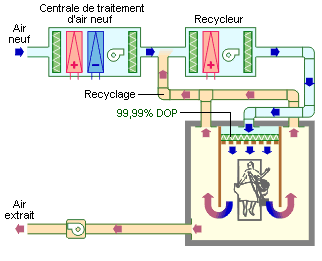
Salles d’opération à flux laminaire horizontal

Flux total : tout le local est balayé par le flux d’air repris sur la paroi opposée.
Remarque : sur le schéma, le chirurgien est mal situé par rapport au flux d’air qu’il risque de contaminer…
Flux partiel :
les filets d’air sont guidés par des parois verticales parallèles et la reprise se fait du côté du panneau filtrant.
L’avantage d’un tel système est la possibilité pour l’équipe chirurgicale de ne pas porter de heaume.
L’inconvénient réside dans la disposition obligatoire du personnel et des équipements en aval de la plaie par rapport au sens du flux.
Salles d’opération à flux laminaire vertical

Le flux laminaire total avec plancher entièrement perforé n’est pas utilisable dans les hôpitaux à cause des exigences de désinfection. On utilise donc un flux partiel couvrant la zone de plus haut risque. La zone couverte est de l’ordre de 3 m sur 3 m. Cette dimension permet aux parois verticales (descendant jusqu’à 1,6 m du sol, avec éventuellement rideaux souples en PVC) guidant le flux de ne pas gêner l’équipe chirurgicale. La reprise se fait en périphérie du flux laminaire.
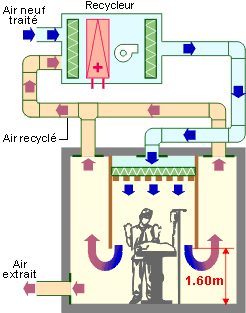
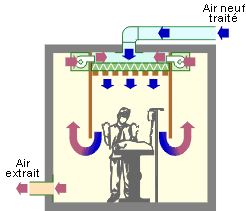
Flux vertical alimenté par une centrale de traitement d’air.
Flux vertical autonome avec ventilateurs incorporés.
Les avantages d’un tel système sont d’une part la liberté de mouvement de l’équipe chirurgicale et les débits d’air à traiter moindre que dans le cas d’un flux horizontal (zone à traiter moindre).
L’inconvénient est le port du heaume conseillé pour garantir la qualité de l’air.
Chambres stériles
Les chambres stériles peuvent être ventilées soit par un flux laminaire horizontal, soit vertical, suivant les typologies recommandées pour les salles d’opération. La zone à protéger sera restreinte au lit du patient, éventuellement à la zone destinée à recevoir le personnel soignant.
5. Zones à risque pour la collectivité hospitalière
| Zones à risques
Zones où il faut protéger la collectivité hospitalière des risques infectieux : chirurgie septique (urologie voie basse, gynécologie, endoscopie), chirurgie très septique (proctologie, abcès, préparation opératoire, zone d’urgence, soins intensifs avec malades infectieux, traitement du matériel côté sale, laboratoire de manipulation de prélèvements biologiques ou germes). |
Objectif : Protection de l’environnement hospitalier par confinement, maîtrise des flux d’air et filtration.
Les prescriptions relatives aux zones à risques pour le patient doivent être complétées en tenant compte des risques pour la collectivité hospitalière. En fonction du degré de risque pour celle-ci, la protection doit comprendre
- Un confinement, c’est-à-dire un isolement du patient et de l’équipe de soins de l’environnement extérieur par des cloisons et des portes fermées, et l’isolation du patient de l’équipe de soins par des cloisons (cabines stériles) et des vêtements spéciaux (scaphandres).
- Une mise en dépression de la zone contaminée complétant le confinement. Selon les risques, un sas en surpression est souvent nécessaire. Dans le cas de très haut risque, le ventilateur d’extraction doit être doublé pour prévenir tout risque de panne et donc d’arrêt de l’installation. Dans tous les cas, le fonctionnement du ventilateur d’extraction doit être asservi au fonctionnement du ventilateur de pulsion.
- Une maîtrise des flux d’air évitant les zones inertes et entraînant le plus rapidement les particules contaminées vers le réseau d’extraction. La disposition des locaux est en ce sens importante.
- Un réseau d’extraction complètement indépendant de ceux des autres locaux.
- Une filtration de l’air extrait au moyen d’un filtre absolu. Ce filtre doit être doublé en cas de très haut risque pour prévenir toute défaillance d’un des filtres.
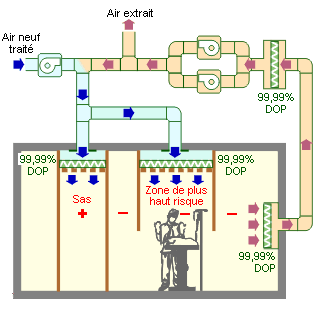
Principe aéraulique du traitement d’air dans une zone à très haut risque pour le patient (flux laminaire vertical) et pour la collectivité hospitalière (sas, double filtration, double ventilateur).
Lorsque le risque de contamination pour la collectivité hospitalière est modéré, il n’est pas nécessaire de maintenir les locaux d’hébergement ou de traitement en dépression. Il s’agit d’une simple mise en quarantaine. Il faut simplement, dans ce cas, rester vigilant quant à la circulation des personnes, du matériel et à la séparation des zones. Le réseau de ventilation recyclage et extraction doit cependant être indépendant pour la zone où on identifie ce risque.
Récupération de chaleur sur l’air extrait
On l’a vu ci-dessus, la plus grosse récupération de chaleur se fait par un taux de recyclage important pouvant dépasser 70 % de flux total d’air pulsé. Les conditions pour pouvoir effectuer ce recyclage sont que l’air recyclé provienne de la même salle que celle dans laquelle il est injecté et que l’air recyclé soit filtré avec la même efficacité que l’air neuf.
On considère souvent que la récupération de chaleur sur l’air extrait n’est financièrement intéressante que lorsque l’on travaille en “tout air neuf”, ce qui n’est jamais le cas dans les solutions techniques présentées ci-dessus. On peut cependant envisager une récupération de chaleur sur l’air extrait lorsque les débits d’air neuf sont importants (jusqu’à 15 vol/h).
| Choix d’un récupérateur de chaleur. |
Il est déconseillé d’utiliser des échangeurs à plaques. En effet, ils sont difficiles à désinfecter, l’agent désinfectant pénétrant mal entre les interstices de faible dimension. L’aluminium est en outre fragile vis-à-vis de ces produits, ce qui risque de provoquer des fuites, donc des contaminations qui ne seront jamais détectées. Si de tels échangeurs sont utilisés, il faut respecter une hiérarchie correcte des pressions entre le conduit d’air neuf et le conduit d’air extrait. Cette pression relative doit être contrôlée régulièrement (un pressostat d’alarme peut signaler toute modification), de même que la concentration de contaminant dans l’air neuf.
Les échangeurs avec fluide calorifique intermédiaire (eau glycolée) ont des rendements de récupération moindre par rapport aux autres systèmes. Cependant, puisqu’il n’y a pas de contact direct entre l’air vicié et l’air neuf, les risques de contamination croisée sont éliminés.
Les échangeurs du récupérateur doivent être disposés au niveau de la pulsion entre les deux premiers étages de filtration, pour qu’ils soient protégés de l’encrassement et pour ne contaminent pas l’air distribué. Les échangeurs sur l’air extrait peuvent aussi être protégés par un filtre pour éviter un encrassement trop rapide.
Autres prescriptions de la norme DIN 1946 pour les salles d’opération
Voici d’autres recommandations, notamment issues de la norme DIN 1946
- Les unités de traitement d’air devraient être composés de panneaux en acier galvanisé double paroi et avec des composants facilement démontables pour être stérilisés.
- Les batteries froides devraient être en acier inoxydable avec des ailettes en aluminium, protégées par une peinture epoxy.
- Les unités de traitement d’air devraient être capables de fonctionner à débit réduit lorsque les salles sont inoccupées, assurant en permanence une pressurisation suffisante. En mode veille, seule la pression de la salle est surveillée. On travaille alors en tout air neuf, sans contrôle de température ni d’humidité. Elles doivent pour cela être équipées de moteurs à vitesse variable.
- Les unités de traitement d’air devraient pouvoir assurer une surpression et une dépression dans les salles d’opération en fonction du type d’intervention (aseptique ou septique) et pouvoir facilement passer dune situation à une autre. Ceci est possible en utilisant des ventilateurs à vitesse variable.
- Les systèmes centralisés et décentralisés (unités montées et réglées en usine) peuvent être utilisés pour traiter l’air des salles d’opération. Cette seconde solution permet une meilleure flexibilité de chaque salle (fonction du type d’intervention et des exigences de chaque chirurgien) et une meilleure fiabilité. Le système de contrôle et la programmation de ces systèmes est réalisé en usine, ce qui limite les risques liés à l’installation et au réglage.

Armoire de climatisation de haute précision.





Auteur : les anciens
Eté 2008 : Brieuc.
Notes : 24.02.09